摘要
目的
研究可吸收骨止血材料用于受试者骨损伤创面的止血有效性和安全性。
方法
将2022年3月至2023年8月就诊于西安交通大学第一附属医院、深圳市第二人民医院、西安市红会医院、北京大学第三医院、北京大学深圳医院、空军军医大学第三附属医院、西安交通大学口腔医院、陕西省人民医院、厦门大学附属第一医院共9家临床研究机构的230例截骨、钻骨或切骨等机械性损伤导致的骨质出血的受试者随机分为可吸收骨止血材料试验组和强生骨蜡(Bone Wax)对照组。试验组共114例,其中男46例,女68例,年龄19 ~ 80岁,平均年龄为(53.33±15.85)岁;对照组共116例,其中男49例,女67例,年龄19 ~ 78岁,平均年龄为(52.10±15.70)岁。本研究主要评价指标为受试者3 min内止血有效率;次要评价指标为受试者切口愈合时间和血红蛋白变化情况;安全性评价指标为受试者术中材料使用不良事件发生率。
结果
试验组与对照组受试者的3 min止血有效率分别为99.12%和99.14%,两组受试者主要评价指标组间差异均无统计学意义(P>0.05)。试验组受试者术后12、30、90 d血红蛋白数值变化正常率分别为42.86%、83.16%和89.52%,对照组受试者术后12、30、90 d血红蛋白数值变化正常率分别为45.95%、81.52%和87.38%;试验组受试者术后12、30、90 d的切口愈合率分别为55.20%、93.86%和97.37%,对照组受试者术后12、30、90 d切口愈合率分别为53.90%、91.23%和98.25%。两组受试者各项次要评价指标评价相比较,差异无统计学意义(P>0.05)。试验组和对照组受试者术后不良反应发生率分别为9.65%和7.76%,两组受试者不良反应发生率比较,差异无统计学意义(P>0.05)。
结论
骨损伤术中使用可吸收骨止血材料产品封闭骨截面止血,临床止血效果良好,且未增加并发症的风险,值得临床推广应用。
因骨组织中含有动静脉及毛细血管,一旦因创伤、感染等原因造成骨损伤后,手术过程中松质骨创面易出现出血不止或难以彻底止血的情况,其严重影响到手术过程操作及术后愈合。由于松质骨血运丰富,且结构松散,其经锐器切割、暴力打击后易出现渗血。松质骨创面难以靠血管收缩自行止血,其不同于其他软组织创面止血,术中难以依靠电凝、钳夹、局部止血材料(如止血纱布、止血海绵)等常规方法止血,因此目前临床手术中最常用的骨损伤止血材料一般为骨蜡(Bone Wax)。该类产品的主要成分为蜂蜡和凡士林等物质的混合物,在临床使用过程中通过黏附于松质骨创面,封闭骨间的出血通路,从而通过物理封堵的原理进行松质骨创面止血。骨蜡于松质骨创面黏附性强,止血快速有效,且价格便宜,但由于骨蜡含动物源性组分,其存在生物相容性差和难以被机体代谢或吸收的问题,临床应用后作为异物长期存留体内,可能形成异物肉芽肿而引起局部疼痛、渗液等不良反
1 资料与方法
1.1 纳入与排除标准
纳入标准:①年龄18 ~ 80周岁,性别不限;②截骨、钻骨或切骨后造成的骨质出血的受试者。排除标准:①试验开始前3个月内曾参与过其他临床试验且未完成所涉及临床试验的受试者;②研究者判断预期寿命少于3个月的受试者;③存在感染的骨损伤表面的受试者;④凝血功能障碍的受试者(具体定义为PT或APTT>正常值上限的1.5倍);⑤处于妊娠期、哺乳期或不能采取有效避孕措施及3个月内有生育计划的受试者;⑥已知对本类产品过敏的受试者(主要为对试验组产品组成成分过敏的受试者);⑦经研究者判断不适合参与本研究的受试者。
1.2 一般资料
本研究选择2022年3月至2023年8月就诊于西安交通大学第一附属医院、深圳市第二人民医院、西安市红会医院、北京大学第三医院、北京大学深圳医院、空军军医大学第三附属医院、西安交通大学口腔医院、陕西省人民医院、厦门大学附属第一医院共9家临床研究机构的截骨、钻骨或切骨等机械性损伤导致的骨质出血的受试者230例,且已完成上述9家临床机构的伦理审批。本试验已在中国临床试验注册中心注册(注册号:ChiCTR2200058464),所有受试者均由研究者进行充分知情,并均已签署知情同意书。
本研究试验组共纳入受试者114例,其中男46例,女68例;年龄19 ~ 80岁,平均为(53.33±15.85)岁,使用可吸收骨止血材料(陕西佰傲再生医学有限公司,规格2.5 g,该产品适用于机械性填塞控制外伤或手术过程中的骨损伤出血)。对照组共纳入受试者116例,其中男49例,女67例;年龄19 ~ 78岁,平均年龄为(52.10±15.70)岁,使用不可吸收骨蜡(Bone Wax,强生公司,规格2.5 g,该产品适用于在控制劈骨、钻骨或切骨后造成的骨质边缘出血时,将其机械性塞入富含出血的毛细血管的骨腔内,以控制出血)。
1.3 研究方法
研究设计按照中央随机系统将所有受试者分为试验组和对照组,采用随机、开放、平行对照、多中心临床研究设计。受试者骨损伤术中常规止血后,通过无菌操作取适量材料直接涂抹于损伤处骨质边缘(见
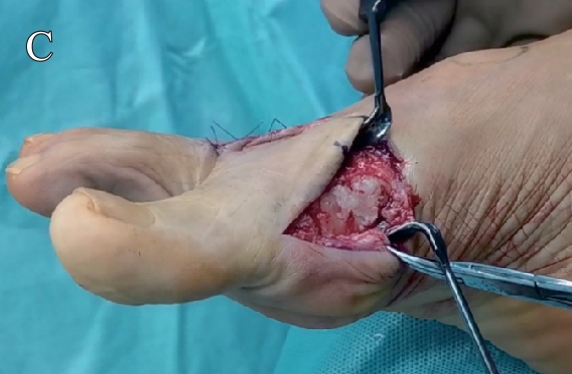
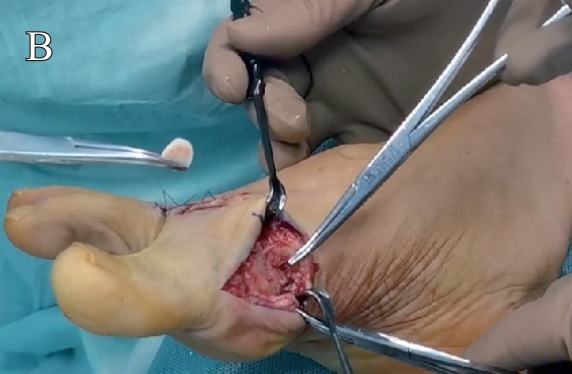
图1 可吸收骨止血材料封闭第二跖骨截骨面:A. 可吸收骨止血材料;B. 跖骨裸露面使用材料封闭前;C.跖骨裸露面使用材料封闭后
1.4 评价指标
1.4.1 主要评价指标
根据《可吸收止血产品注册技术审查指导原则》(2016年第7号)等相关法规或文献要
受试者术中使用研究材料后立即观察止血时间,有效时间为3 min;若使用研究材料后大于3 min仍未止血,该方法视为无效,需及时采取其他外科止血方式控制出血。治疗有效率计算公式为:
| 。 |
1.4.2 次要评价指标
术后(12±3)d监测血红蛋白变化和切口愈合率;②术后(30±3)d监测血红蛋白变化和切口愈合率;③术后(90±7)d监测血红蛋白变化和切口愈合率。
1.4.3 安全性评价
本临床研究主要通过不良事件的发生情况进行安全性评价。对试验组和对照组受试者在临床研究期间发生的不良事件进行了记录及统计,根据临床试验方案所规定的不良事件判定标准,本次研究的不良事件主要包括:与试验有关的不良事件、与试验无关的不良事件、与研究材料有关的不良事件,和与研究材料无关的不良事件四类。本文主要针对与研究材料有关的不良事件进行分析,同时对受试者术后炎症反应发生率进行对比研究。主要评价与两组研究材料可能相关的不良反应发生率,计算方法:不良反应发生率(%)=发生不良反应例数/试验组或对照组总例数×100%。
1.5 统计学方法
应用SAS 9.4统计软件进行统计学分析。采用
2 结果
2.1 术前基线资料比较
对试验组和对照组受试者的性别分布和年龄分别进行比较,组间差异均无统计学意义(P>0.05),见
| 组别 | 例数 | 性别(例) | 年龄(岁) | |
|---|---|---|---|---|
| 男 | 女 | |||
| 试验组 | 114 | 46 | 68 | 53.33±15.85 |
| 对照组 | 116 | 49 | 67 | 52.10±15.70 |
| t值 | 0.085 | 0.588 | ||
| P值 | 0.771 | 0.557 | ||
2.2 主要评价指标
试验组受试者3 min内止血有效率为99.12%,对照组受试者3 min内止血有效率为99.14%,两组组间比较差异无统计学意义(P>0.05),见
| 组别 | 例数 | 3 min内止血有效率 |
|---|---|---|
| 试验组 | 114 | 99.12(113) |
| 对照组 | 116 | 99.14(115) |
|
| -0.02% | |
| P值 | 1.0000 |
2.3 次要评价指标
试验组和对照组受试者术后12、30、90 d手术切口愈合情况和血红蛋白变化情况分别如
| 组别 | 例数 | 术后血红蛋白数值正常率(%) | 术后手术切口愈合率(%) | |||||
|---|---|---|---|---|---|---|---|---|
| 术前 | 术后12 d | 术后30 d | 术后90 d | 术后12 d | 术后30 d | 术后90 d | ||
| 试验组 | 114 | 80.70 | 42.86 | 83.16 | 89.52 | 55.20 | 93.86 | 97.37 |
| 对照组 | 116 | 87.93 | 45.95 | 81.52 | 87.38 | 53.90 | 91.23 | 98.25 |
|
| 2.121 | 0.016 | 0.082 | 0.221 | 0.038 | 0.572 | 0 | |
| P值 | 0.145 | 0.900 | 0.775 | 0.639 | 0.846 | 0.449 | 1 | |
2.4 安全性评价
试验组和对照组受试者均发生了可能与研究材料有关的不良反应(见
| 组别 | 例数 | 不良反应发生率[%(例数)] | |
|---|---|---|---|
| 与研究材料有关的不良事件 | 炎症反应 | ||
| 试验组 | 114 | 9.65(11) | 1.76(2) |
| 对照组 | 116 | 7.76(9) | 5.17(6) |
| 统计量 | - | - | |
| P值 | 0.6467 | 0.2127 | |
3 讨论
作为人体运动系统的重要组成部分,骨骼中含有丰富的血管来输送血液。由于骨独特的结构,当手术或创伤造成骨破坏时,骨性出血常常是一个临床中难以控制的问题。由于骨蜡具有良好的操作性、骨黏附性和延展性,因此常被作为骨科、神经外科、心胸外科、颌骨及牙科手术中骨止血填塞剂使用,但因其不可降解导致临床应用时引发如术后阻碍骨愈合、组织感染、异物排斥反应及神经压迫等一系列问
理想的骨止血材料应具有良好的生物相容性、可降解吸收、骨黏附性和易操作性。国内外目前已有的研究显示,术中使用可吸收骨蜡材料相较于传统骨蜡不会引起相关并发症,或所引起的并发症程度减轻,且与传统止血方式相比,可吸收骨蜡能够有效改善临床效果,出血量和术后并发症发生率明显降低,其于松质骨创面止血效果明显优于常规的止血措
本研究中试验组采用的可吸收骨止血材料由泊洛沙姆、天然多糖等有机材料与无机钙盐组成,各组分均无动物源性,于室温下易塑型,且易溶于水,可于体内49 d左右代谢吸收,主要通过机械性填塞控制外伤或手术中的骨损伤出血。在临床试验开展前,根据GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验
因此,根据上述随机、开放、平行对照、多中心临床试验研究结果表明,可吸收骨止血材料于骨缺损的止血效果与骨蜡相当,在临床使用过程中具有良好的止血有效性和生物相容性。同时其使用便捷,可于体内代谢吸收,解决了现有不可吸收骨蜡因不能降解吸收而影响骨愈合等临床问题。作为现有骨蜡的升级产品,可吸收骨止血材料于临床使用安全、有效、便捷,适宜骨科手术中推广使用。
参考文献
Das JM. Bone wax in neurosurgery: A review[J]. World Neurosurg, 2018, 116: 72-76. [百度学术]
Panicker R, Moorthy RK, Rupa V. Unusual complications of bone wax at the skull base[J]. J Laryngol Otol, 2021, 135(3): 217-223. [百度学术]
国家药品监督管理局. 可吸收止血产品注册技术审查指导原则(2016年第7号)[EB/OL]. (2016-01-27)[2024-04-16]. https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20160127150301389.html. [百度学术]
张世庆, 赵雄, 鲁景艳, 等. 可吸收止血材料研究现状与相关技术要求[J]. 军事医学, 2012, 36(11): 862-866. [百度学术]
刘锐, 李辉, 杨俊峰, 等. 可吸收止血胶原海绵在心脏外科术中胸骨止血的应用体会[J]. 心肺血管病杂志, 2014, 3(5): 719-721. [百度学术]
Fahradyan A, Ohanisian L, Tsuha M, et al. An unusual complication of bone wax utilization[J]. J Craniofac Surg, 2018, 29(4): 976-979. [百度学术]
Yu L, Gu T, Song L, et al. Fibrin sealant provides superior hemostasis for sternotomy compared with bone wax[J]. Ann Thorac Surg, 2012, 93(2): 641-644. [百度学术]
Alkan A, Inal S, Yildirim M, et al. The effects of hemostatic agents on peripheral nerve function: An experimental study[J]. J Oral Maxillofac Surg, 2007, 65(4): 630-634. [百度学术]
Schonauer C, Tessitore E, Barbagallo G, et al. The use of local agents: bone wax, gelatin, collagen, oxidized cellulose[J]. Eur Spine J, 2004, 1(Suppl 1): S89-S96. [百度学术]
Zhou H, Ge J, Bai Y, et al. Translation of bone wax and its substitutes: history, clinical status and future directions[J]. J Orthop Translat, 2019, 17: 64-72. [百度学术]
Vestergaard RF, Jensen H, Vind-Kezunovic S, et al. Bone healing after median sternotomy: A comparison of two hemostatic devices[J]. J Cardiothorac Surg, 2010, 5: 117. [百度学术]
Pingsmann A, Blatt R, Breusch S, et al. Efficacy and safety of a novel moldable, resorbable, and degradable sealant of bone surfaces for hemostasis after bone graft harvesting from the iliac crest[J]. Spine (Phila Pa 1976), 2005, 30(17): 1911-1917. [百度学术]
Choi SY, Rhim J, Heo SA, et al. Efficacy and safety of a novel hemostatic material, Bone Stat, compared with Ostene and Bone Wax in a rat calvarial defect model[J]. Int J Artif Organs, 2021, 44(10): 734-747. [百度学术]
Kim JK, Ro DH, Han SM, et al. Efficacy and safety of bioabsorbable bone hemostatic agent in total knee arthroplasty: A prospective randomized controlled trial[J]. Clin Appl Thromb Hemost, 2021, 27: 10760296211023589. [百度学术]
全国医疗器械生物学评价标准化技术委员会. 医疗器械生物学评价 第1部分:风险管理过程中的评价与试验: GBT16886.1—2022[S]. 北京: 中国标准出版社, 2022. [百度学术]